Introducción
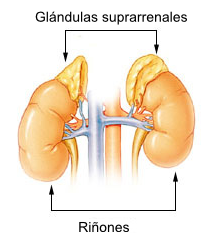
La enfermedad de Addison se caracteriza por una oferta insuficiente de hormonas corticosuprarrenales para mantener las demandas periféricas y cursa como un síndrome constitucional con melanodermia e hipotensión. En la mayoría de los casos (80%) es secundario a un proceso de atrofia de la corteza suprerrenal de origen autoimmune. A principios de siglo, la causa principal de insuficiencia corticosuprarrenal era la tuberculosis extrapulmonar pero la reciente baja en la incidencia de la tuberculosis ha cedido el paso a la enfermedad autoimmune como principal etiología. Está última será el objetivo central del siguiente artículo.
Epidemiologia
Tiene una incidencia de 0.83 casos por cada 100,000, con una prevalencia de 4-6 por cada 100,000. La edad media de presentación es de 30-80 años. Es tres veces más frecuente en el sexo femenino.
Etiopatogenia.
Al igual que la mayoría de las enfermedades autoinmunes, la enfermedad de Addison requiere una compleja relación entre factores ambientales y genéticos para su desencadenamiento:
Elementos ambientales inductivos:
Las infecciones virales en individuos genéticamente predispuestos pueden desencadenar la autoinmunidad. Se han relacionado infecciones por Klebsiella pneumoniae y el desarrollo de la enfermedad de Addison. El mecanismo por el cuál se origina la autoinmunidad no se conoce con exactitud pero se sospecha de mimetismo molecular, y aumento de la presentación antigénica de autoantígenos durante la infección, secundario a un aumento en la secreción de IL-2.
Predisposición genética:
Se han descrito dos síndromes poliglandulares de naturaleza auto inmune (SPA I y SPA II), que presentan cierta susceptibilidad genética, entre los cuales se encuentra la enfermedad de Addison. Estos síndromes son debidos al desarrollo de linfocitos T o anticuerpos contra proteínas de las células glandulares y no glandulares. Existe un al menos un antecedente familiar de la enfermedad en un 30-50% de los pacientes. Estos trastornos en la inmunoregulación son dependientes varios genes HLA (cromosoma 6), más específicamente en los alelos DR3 y B8. El hecho de que solo un porcentaje de los pacientes con los genes predisponentes presente la enfermedad sugiere que puede haber otros genes relacionados o que los factores ambientales juegan un papel fundamental.
Autogénesis:
 Más del 50% de los pacientes presentan anticuerpos frente a la corteza suprarrenal, aunque los niveles séricos de los mismos son bajos (ligeramente mayor en el sexo femenino). Su presencia indica cierta predisposición a la enfermedad, ya que son evidencia de una alteración inmunológica. Los autoanticuerpos por si solos no representan daño para la corteza suprarrenal ya que el verdadero daño al tejido es de tipo celular, por un aumento de linfocitos TH2 y diminución de linfocitos superiores (TH3).
Más del 50% de los pacientes presentan anticuerpos frente a la corteza suprarrenal, aunque los niveles séricos de los mismos son bajos (ligeramente mayor en el sexo femenino). Su presencia indica cierta predisposición a la enfermedad, ya que son evidencia de una alteración inmunológica. Los autoanticuerpos por si solos no representan daño para la corteza suprarrenal ya que el verdadero daño al tejido es de tipo celular, por un aumento de linfocitos TH2 y diminución de linfocitos superiores (TH3).
Se sospecha que las infecciones virales causan lisis de las células, liberando ciertas moléculas al medio extracelular, como la 17 y 21 hidroxilasa. Estás enzimas son captadas por las células presentadoras de antígeno, las cuales desencadenan la respuesta inmune al activar a linfocitos T citotóxicos contra la corteza suprarrenal.
Otra posible causa de la autoinmunidad es la expresión aberrante de moléculas HLA de tipo II por parte de las células de la corteza soprarrenal, secundaria al ambiente pro inflamatorio. De está manera las células del mismo tejido cumplen la función de células presentadoras de antígeno.
Efectos histológicos y metabólicos
El daño tisular comienza a evidenciarse con una disminución homogénea y bilateral de la corteza suprarrenal (caso contrario a la adrenintis tuberculosa, en la cual el daño suele ser unilateral y heterogéneo.) hasta llegar a una delgada lamina de tejido fibroso. Existe infiltración linfocitaria capsular que respeta la médula suprarenal. La destrucción de la corteza causa una deficiencia de gluco y mineralocorticoides. Los niveles bajos de estas hormonas interfieren con la retroalimentación negativa a nivel hipotalámico, causando niveles elevados de CRH y ACTH.
Signos y síntomas
Se pueden clasificar según la deficiencia de cada hormona:
- Deficiencia de glococorticoides (cortisol): Cursa con disminución de la gloconeogénesis que provoca hipoglucemia, astenia, adinamia y fatigabilidad muscular. Perdida de peso, diaforesis, dolor abdominal y cefalea. Pueden existir trastornos psicológicos como fatiga mental, depresión, irritabilidad, insomnio, e inquietud.
- Deficiencia de mineralocorticoides: A medida que se va destruyendo la corteza suprarrenal, los niveles de renina y angiotensina II a nivel plasmatico aumentan con el fin de mantener niveles normales de aldosterona, hasta que el grado de destrucción es tal que concluye con hipoaldosteronismo. Por consiente se pierden cantidades grandes de agua y sodio, lo que condiciona hipovolemia con hipotensión arterial y taquicardia refleja. Se suele presentar síncope, vértigo y avidez por la sal.
- Deficiencia de andrógenos: Pérdida del vello axilar y pubiano. Oligomenorrea y disminución del la líbido en ambos sexos.
El aumento de ACTH también causa con aumento de su precursor, la propiomielocortina. El aumento de la POMC causa un incremento del factor estimulante de melanocitos y una hiperpigmentación de la piel característica de la enfermedad de Addison. Dicha pigmentación suele encontrarse dentro o alrededor de la boca y en las manos.
Los síntomas pueden presentarse o exacerbarse de forma repentina bajo condiciones de estrés, ya que estoy aumenta las demandas de glococorticoides, en lo que se conoce como crisis Addisonianas.
Diagnóstico
Clínico: Por los signos y síntomas mencionados anteriormente y los antecedes heredo familiares.
Laboratorio:
- Biometría hemática: Anemia normocítica y normocrómica.
- Química sanguínea: Hipoglucemia e hiponatremia. En un 10-20% de los pacientes se ha encontrando hipercalcemia.
- Estudios hormonales: Elevación de la ACTH (Mayor a 50pg/l). En etapas iniciales los niveles de corticoesteroides pueden ser normales y en estadios avanzados llegar a ser imperceptibles (menores a 5mg/dl)
- Test de estimulación con ACTH. Puede ser rápida o prolongada, siento este último el de verdadero valor diagnóstico en la enfermedad de Addison. Consiste en la administración exógena de ACTH por tres días. Si después de dicho periodo los niveles de corticoesteroides se mantienen bajos, se trata de la enfermedad de Addison. Si hay respuesta a la ACTH exógena, se debe orientar el diagnóstico a ineficiencia hipofisiaria. La interpretación de los resultados se muestra a continuación.
- Diagnóstico inmunológico: La determinación de anticuerpos contra la corteza suprarrenal indica riesgo a padecer la enfermedad pero no un diagnóstico certero. Recientemente se han ensayado técnicas para la detección de enzimas estereoidogénicas, como la 17 y 21 hidroxilaza, las cuales poseen una mayor sensibilidad y especificidad.
Tratamiento
Tratamento tradicional:
Consiste en la administración de los gluco y mineralocorticoides que no se sintetizan. El fármaco de elección suele ser hidrocortisona o cortisona, ya que presenta un efecto dual (actúan como gloco y como mineralocorticoides). Las dosis de mantenimiento es de 20-25mg cada 24 horas de hidrocortisona o 25-35mg cada 24 horas de cortisona.
Nuevos tratamientos:
Implante subcutáneo de de desoxicorticoesterona. Se implantan directamente 500mg y la dosis se repite cada 6 a 12 meses, según el estado del paciente. Normalmente se colocan haciendo una pequeña inacción en el abdomen.
Bibliografía:
- Arthur C. Guyton . (2011). Tratado de fisiología humana. Madrid, España: Elsevier .
- F. J. CANDEL GONZÁLEZ, M. MATESANZ DAVID, I. CANDEL MONSERRATE. (2001). Insuficiencia corticosuprarrenal primaria. Enfermedad de Addison. AN. MED. INTERNA, 18, 492-498.