Lecturas recomendadas: Apendicitis: Diagnóstico diferencial
domingo, 16 de abril de 2017
domingo, 2 de abril de 2017
Diabetes mellitus tipo 1
 La diabetes mellitus tipo 1 es un transtorno catabólico en el cual existe una disminución progresiva de la insulina circulante con con aumento de glocagón como mecanismo compensatorio y en dónde las células beta del páncreas no responden a estímulos para la secreción de insulina. Puede ser autoimmune en un 95% de los casos y el otro 5% de origen idiopático. Los efectos de la deficiencia de insulina son muy marcados en hígado, músculo estriado y tejido graso, los cuales, además de no poder nutrirse de manera adecuada, continúan enviando al plasma cantidades aumentadas de glucosa, aminoácidos y ácidos grasos, lo cuál causa alteraciones metabólicas en todo el organismo.
La diabetes mellitus tipo 1 es un transtorno catabólico en el cual existe una disminución progresiva de la insulina circulante con con aumento de glocagón como mecanismo compensatorio y en dónde las células beta del páncreas no responden a estímulos para la secreción de insulina. Puede ser autoimmune en un 95% de los casos y el otro 5% de origen idiopático. Los efectos de la deficiencia de insulina son muy marcados en hígado, músculo estriado y tejido graso, los cuales, además de no poder nutrirse de manera adecuada, continúan enviando al plasma cantidades aumentadas de glucosa, aminoácidos y ácidos grasos, lo cuál causa alteraciones metabólicas en todo el organismo.Epidemilogía
Se calcula que actualmente viven 420,000 niños menores de 15 años con diabetes mellitus tipo 1 y que aumentará otros 72,000 en los próximos 5 años. La mayor incidencia a nivel mundial se encuentra en Europa, con un 25% de todos los casos diagnosticados, le sigue el Sudeste asiático con un 23% y América del norte y el caribe con 19%. El índice de mortalidad varia dependiendo de cada país: En EE.UU se estima un total de 0.63 muertes por cada 100,000 pacientes, mientras que en Sudán está cifra aumenta a 42.6. La diferencia radica en un diagnóstico oportuno y acceso a la insulina.
La diabetes mellitus tipo 1 puede presentarse a cualquier edad pero los picos de incidencia se observan en edad escolar y de nuevo en la pubertad. No se ha observado prevalencia por ningún sexo.
Autoinmunidad y DM tipo 1
La mayoría de los pacientes presentan auto anticuerpos contra moléculas de las células beta como son: antígenos antiislotes, antiinsulina y contra de descargoxilasa de ácido glutámico (GAD65). Si bien la presencia de los autoanticuerpos no condicionan la presencia de la enfermedad, son indicadores de un trastorno inmunológico. La concentración de los mismos puede variar durante la evolución natural de la enfermedad, siendo elevados antes del diagnóstico y con tendencia a disminuir después de recibir tratamiento.
 A pesar de ser muy importantes para el diagnóstico de la DM tipo 1 (véase más adelante), los autoanticuerpos no son los causantes de la destrucción de las células beta, son los linfocitos T citotóxicos los que llevan acabo dicho proceso, inflitrandose en los islotes de Langerhans en un proceso llamado insulinitis, para después causar apoptosis de las célula.
A pesar de ser muy importantes para el diagnóstico de la DM tipo 1 (véase más adelante), los autoanticuerpos no son los causantes de la destrucción de las células beta, son los linfocitos T citotóxicos los que llevan acabo dicho proceso, inflitrandose en los islotes de Langerhans en un proceso llamado insulinitis, para después causar apoptosis de las célula.En condiciones normales, el timo es el encargado de la destrucción de las clonas de linfocitos T autorreactivas, en la diabetes mellitus tipo 1 existe una falla en estos mecanismos reguladores, causando que los linfocitos que reconocen a las células beta como extrañas salgan a la circulación y las destruyan.
Según la presencia de autoanticuerpos, podemos clasificar a la DM en dos grupos:
- DM tipo 1a: Aquella dónde están presentes, siendo el anticuerpo contra GAD65 el más común y el primero en ser descubierto, por ello, son los más útiles clínicamente. Está enzima, además de encontrarse en las células pancreáticas, también está en las neuronas inhibitorias del sistema nervioso, por lo que algunos pacientes que presentan los autoanticuerpos también cursan con destrucción de dichas neuronas originando una extraño síndrome llamado Sx de la persona rígida. Cerca de la mitad de los pacientes con este síndrome presentan DM tipo 1, contrariamente, muy pocos pacientes con DM tipo 1 cursan son el síndrome.
- DM tipo 1b: Cerca del 5% de los pacientes con diabetes mellitus tipo 1 no presentan auntoanticuerpos circulantes. Se sospecha que la causa de la destrucción de las células en estos pacientes sea una destrucción autoninmune de tipo celular sin la presencia de anticuerpos o de un proceso no dependiente del sistema inmune.
Factores genéticos
La importancia de un componente genético en el desarrollo de la enfermedad se ha demostrado en diversos estudios dónde se demuestra que las personas con tipos específicos de genes HLA están predispuestos a padecerla. En gemelos monocigóticos, la tasa de concordancia es del 25 al 50%. El hecho de que no todos los pacientes con los genes predisponentes presenten la enfermedad evidencia que también existen factores ambientales que juegan un rol importante.
Los genes en el locus del complejo mayor de histocompatibilidad (MHC) en el brazo corto del cromosoma 6 explican por lo menos la mitad de la agregación familiar de la DB tipo 1. Estos genes se encuentran los genes de HLA tipo II, DR y DQ, los cuales se encuentran en las células presentadoras de antígeno como los macrófagos, células dentríticas, linfocitos B, entre otras. Se desconoce el mecanismo exacto por el cual ciertos haplotipos de estos genes predisponen la enfermedad pero se sospecha de una disminución en la autotolerancia y un aumento de la activad presentadora de autoantígenos, lo cuál concluye con la activación de linfocitos T citotóxicos contra células beta.
La importancia de un componente genético en el desarrollo de la enfermedad se ha demostrado en diversos estudios dónde se demuestra que las personas con tipos específicos de genes HLA están predispuestos a padecerla. En gemelos monocigóticos, la tasa de concordancia es del 25 al 50%. El hecho de que no todos los pacientes con los genes predisponentes presenten la enfermedad evidencia que también existen factores ambientales que juegan un rol importante.
Los genes en el locus del complejo mayor de histocompatibilidad (MHC) en el brazo corto del cromosoma 6 explican por lo menos la mitad de la agregación familiar de la DB tipo 1. Estos genes se encuentran los genes de HLA tipo II, DR y DQ, los cuales se encuentran en las células presentadoras de antígeno como los macrófagos, células dentríticas, linfocitos B, entre otras. Se desconoce el mecanismo exacto por el cual ciertos haplotipos de estos genes predisponen la enfermedad pero se sospecha de una disminución en la autotolerancia y un aumento de la activad presentadora de autoantígenos, lo cuál concluye con la activación de linfocitos T citotóxicos contra células beta.
Los haplotipos DR3 y DR4 se encuentran presentes en un 95% de los pacientes con DM tipo 1
Factores ambientales
Debido a que no todas las personas con los genes predisponentes desarrollan la enfermedad, se asume que los factores ambientales juegan un rol igual de importante que los genéticos. Se han acostado infecciones virales como rubeola, paperas, coxacie B4 y sustancias químicas como la nitrofenilurea.
Aunque el mecanismo por el cual estos factores intervenir no está bien esclarecido, se sospecha que predisponen la rotura de células beta, dejando libres muchas de las proteínas intracelulares de las mimas. Está liberación hace que sea más fácil para los linfocitos autorreactivos reconocerlos y desencadenar una respuesta.
Diagnóstico
Los pacientes con diabetes mellitus tipo 1 presentan síntomas relacionados con la hiperglucemia y la hipercetonemia, la intensidad de los signos y síntomas dependerá de la gravedad del exceso osmótico y la cetosis
Síntomas
- Poliuria: Producida por una diuresis osmótica secundaria a una hiperglucemia sostenida. Causa perdida de agua, electrolitos y glucosa en la orina
- Enuresis nocturna: Puede indicar el inicio de la DM en niños y es secundario a la poliuria
- Polidipsia: Se produce como mecanismo compensatorio al estado hiperosmolar.
- Perdida de peso: Es causado por la lipólisis y la proteólisis que a su vez se generan por la falta de glucosa intracelular, ya que los aminoácidos se derivan para formar glucosa mediante la gloconeogénesis.
- Debilidad: Es originada por la perdida de masa muscular y de potasio en la orina
Cuando las demandas metabólicas aumentan, la deficiencia insulínica se hace más grave lo cual empeora todos los síntomas mencionados anteriormente. Cuando la osmolaridad aumenta por arriba de 300 mOsm/kg, sobrevienen alteraciones neurológicas. Si el pH baja más de 7.1, se presentan respiraciones profundas y aceleradas (como mecanismo compensatorio a la acidosis metabólica) llamadas: Respiración de Kussmaul. Si el sistema vascular es incapaz de mantener la vasoconstricción como mecanismo compensatorio a la hipovolemia, se puede producir choque.
Signos
El nivel de conciencia varia según el grado de hiperosmolaridad, pudiendo presentar estupor, o incluso coma. Cuando las cetonas se encuentran muy elevadas se produce aliento con olor a frutas. La presencia de hipotensión postural indica hipovolemia.
Las diferencias entre los signos y síntomas de DM tipo 1 y tipo dos se resumen en la siguiente tabla:
Laboratorio
- Glucosa en orina: Es una prueba que cuantificar la cantidad de glucosa excretada en la orina y se toma como referencia para la cantidad de glucosa plasmática. Presenta el inconveniente de que refleja la cantidad de glucosa que había en el momento en que se formó la orina y no en el momento en que esta es expulsada. El rango normal es de 0 a 0.8mmol/litro
- Análisis de glucosa en sangre: La muestra puede ser tomada de sangre venosa, arterial o capilar, siendo esta última la más usada ya que no requiere personal calificado y puede ser tomada por el mismo paciente en su casa, además de ser económica, rápida y eficaz. Para el diagnóstico de DM el valor debe ser superior a 126mg/dL
- Análisis de hemoglobina glucosidada (HbA1c): La hemoglobina glucosidada es una fracción de la hemoglobina en la cual se adhiere glucosa en la valina aminoterminal. Está variante de la molécula se encuentra anormalmente elevada en los pacientes con DM, por lo cuál se utiliza como método diagnóstico. Debido a que la hemoglobina percance unida a los eritrocitos por 120 días (vida media de estas células), la prueba de hemoglobina glocosidada permite cuantificar la cantidad de glucosa en plasma por periodos de hasta 4 meses. Se mide en cuanto al porcentaje de alteración.
Los valores de los datos de laboratorio más importantes se resumen en la siguiente tabla.
Cabe mencionar que existen otras pruebas como son la glucosa en líquido intersticial, las pruebas de tolerancia a la glucosa, entre otras.
Tratamiento
Dieta: Es el pilar angular en el tratamiento de la diabetes, el propósito de la misma debe ser mantener niveles plasmáticos de glosa dentro de rangos optimos así como evitar el consumo de grasas. La ADA recomienda la siguiente distribución:
- Carbohidratos: 45-65%
- Grasas 25-35%
- Proteínas: 10-35%
 Insulina: Debido a que la destrucción de las células beta es progresiva, se vuelve indispensable la administración de insulina exógena. Inicialmente la insulina se obtenía de páncreas de cerdo pero con el tiempo este tratamiento aumentaba aún más la presencia de anticuerpos contra insulina y rápidamente se generaba resistencia contra la misma. La insulina que se utiliza actualmente se obtiene mediante ingeniería genética a través de cepas de E.coli modificadas para producir insulina recombinante humana, la cual es exactamente igual a la producida por las células beta. Existen de efecto ultra rápido, rápido, intermedio y prolongado. Siendo la insulina de liberación intermedia (NPH) la más usada. En la siguiente gráfica se esquematizan los perfiles de actividad de los distintos tipos.
Insulina: Debido a que la destrucción de las células beta es progresiva, se vuelve indispensable la administración de insulina exógena. Inicialmente la insulina se obtenía de páncreas de cerdo pero con el tiempo este tratamiento aumentaba aún más la presencia de anticuerpos contra insulina y rápidamente se generaba resistencia contra la misma. La insulina que se utiliza actualmente se obtiene mediante ingeniería genética a través de cepas de E.coli modificadas para producir insulina recombinante humana, la cual es exactamente igual a la producida por las células beta. Existen de efecto ultra rápido, rápido, intermedio y prolongado. Siendo la insulina de liberación intermedia (NPH) la más usada. En la siguiente gráfica se esquematizan los perfiles de actividad de los distintos tipos.Se establece una dosis inicial en cuanto al peso y se cita al paciente para ver como se mantienen sus niveles de glucosa, en base a los datos obtenidos se determina si la dosis se aumenta, se mantiene o se disminuye, como en el siguiente ejemplo:
Es muy importante la educación de los pacientes con DM mellitus ya que el éxito del tratamiento depende mucho de su cooperación.
Cabe mencionar que alteraciones en la rutina como incremento o decremento en la ingesta de carbohidratos, ejercicio y estados de estrés, pueden causar estados de hiper o hipoglucemia.
Bibliografía
- David G.Gardner. (2012). Endocrinologia básica y clínica . Madrid, España: Mc GrawHill.
- American Diabetes Association. (2017). Standards of Medical Care in Diabetes . Diabetes Care, 40, 15-30.
sábado, 18 de marzo de 2017
Enfermedad diverticular
Definición
Los diverticulos son protruciones seculares (herniaciones) de la mucosa y la submucosa através de la capa muscular del tracto digestivo. Comúnmente se encuentran en el intestino delgado pero pueden ubicarse en el colón y el esófago. Mieden entre 5 y 10mm aunque algunos pueden alcanzardimensiones de hasta 20mm.
Los divertículos son realmente pseudodivertículos ya que contienen solo mucosa y submucosa cubiertas de cerosa. Un divertículo propiamente dicho se abarca todas las capas del intestino.
La presencia de divertículos en el colón es un estado denominado diverticulosis. Estos pacientes pueden ser asintomáticos y el diagnóstico se hace por hallazgo. Cuando los divertículos se inflaman se origina una patología llama diverticulitis la cual generalmente presenta signos y síntomas que veremos a continuación.
Epidemiología
La población más vulnerable está comprendida por adultos mayores. De hecho el 50% de los pacientes mayores de 50 años presenta divertículos en el colon. La incidencia aumenta conforme a la edad de modo que un 65% de los pacientes con enfermedad diverticular son mayores de 65 años. Se observa una prevalencia del sexo masculino antes de los 50 años. Entre los 50-70 años existe una leve preponderancia en el sexo femenino siento este último el más común en pacientes mayores de 70 años.
Etiología
Dieta baja en fibra: El bajo consumo de fibra en la dieta fue atribuido como causa de la enfermedad diverticular por primera vez por Painter y Burkitt a finales de los 50s. Si bien en un principio la teoría fue recibida con resistencia, se comprobó su estrecha relación al realizar seguimiento a los pacientes con diverticulosis. Diversos estudios han demostrado que el riesgo de padecer ED (enfermedad diverticular) es 58% mayor en aquellas personas con una dieta baja en fibra a demás de que la incidencia de ED es mucho menor en vegetarianos.
La fibra ayuda a disminuir la incidencia de ED debido a que la fibra insoluble ayuda a excretar heces más blandas, las cuales son más fáciles de movilizar atreves de colón, con lo cual la presión dentro del mismo se mantiene dentro de los valores normales.
Dieta rica en carnes rojas y grasas: Se ha observado relación entre los pacientes con una dieta rica en carnes rojas y en grasas animales. Aunque este riesgo se puede disminuir al incluir una adecuada cantidad de fibra en la dieta, preferentemente de origen celulósico (frutas y verduras).
Otros: Se ha asociado al sedentarismo y a la obesidad.
Otros: Se ha asociado al sedentarismo y a la obesidad.
Patogenia
 Los divertículos se forman en puntos débiles de la musculatura del colon. En el lugar de inversión de los vasos recta intramusculares. No se conoce con exactitud los mecanismos responsables de este trastorno pero en su patógena intervienen alteraciones anatómicas intrínsecas y trastornos de la motilidad del colon. Eso se infiere debido a que en la mayoría de los pacientes con diverticulosis se observa un engrosamiento de las tenias y de la capa muscular al mismo tiempo que se encuentran alteraciones de la motilidad. Estos fenómenos condicionan un aumento de la presión en la luz del colon y la segmentación intestinal. El exceso de segmentación (deformidad denominada miocosis) condiciona un retardo en la motilidad intestinal lo cual favorece la absorción de agua. Todo lo
Los divertículos se forman en puntos débiles de la musculatura del colon. En el lugar de inversión de los vasos recta intramusculares. No se conoce con exactitud los mecanismos responsables de este trastorno pero en su patógena intervienen alteraciones anatómicas intrínsecas y trastornos de la motilidad del colon. Eso se infiere debido a que en la mayoría de los pacientes con diverticulosis se observa un engrosamiento de las tenias y de la capa muscular al mismo tiempo que se encuentran alteraciones de la motilidad. Estos fenómenos condicionan un aumento de la presión en la luz del colon y la segmentación intestinal. El exceso de segmentación (deformidad denominada miocosis) condiciona un retardo en la motilidad intestinal lo cual favorece la absorción de agua. Todo lo anterior ayuda a incrementar aún más la presión intracolónica. Dicho aumento de presión favorece la herniación de la mucosa en los puntos débiles. A pesar de esto se han encontrado pacientes en los cuales no existe elevación de la presión intracolónica lo cual sugiere que existen otros mecanismos involucrados en el desarrollo de la ED.
Una hipótesis alternativa sugiere que la formación de divertículos son consecuencia de la degeneración vagal, trastorno relacionado estrechamente con el envejecimiento. Como efecto compensatorio se generará una hipersensibilidad colinérgica que terminará causando una disfunción de la musculatura lisa del colón y finalmente en la formación de divertículos.
Localización
 Los divertículos suelen encontrarse en el colon izquierdo, los porcentajes por zonas son los siguientes:
Los divertículos suelen encontrarse en el colon izquierdo, los porcentajes por zonas son los siguientes:- Colon sigmoides: 50%
- Colon descendente: 40%
- Resto del colon: 5-10%
Es importante recalcar el hecho de que nunca se encuentran divertículos en el recto
Para fines de diagnóstico y tratamiento, podemos dividir a la enfermedad diverticular en:
- Complicada o sintomática
- No complicada o asintomática
Diverticulosis no complicada
Diagnóstico
Aproximadamente el 75% de los pacientes con divertículos en el colon permaneces asintomáticos. A pesar de esto, existe un porcentaje indeterminado de pacientes que presentan síntomas inespecíficos como son:
Aproximadamente el 75% de los pacientes con divertículos en el colon permaneces asintomáticos. A pesar de esto, existe un porcentaje indeterminado de pacientes que presentan síntomas inespecíficos como son:
- Dolor abdominal con predominancia en el hipogastro
- Flatulencia
- Cambios en el hábito intestinal
- Estreñimiento
El dolor suele presentarse después de la ingesta de alimentos y mejorar después de la defecación. La exploración de abdomen suele ser normal. Dicho cuadro clínico pueden confundir el diagnóstico con el de intestino irritable
Durante muchos años el enema opaco fue la técnica de imagen más utilizada para el diagnóstico de ED. Esta técnica nos permite cuantificar los diverticulosis ademas de proporcionar su localización y tamaño. Sin embargo el enema opaco es una técnica como precisa además de presentar una taza alta de falsos negativos y positivos para pólipos o neoplasia colónica. Por lo tanto se recomienda hacer una colonoscopía en todos los pacientes con diverticulosis sintomática. A continuación se mientras imágenes de ambos estudios:
Enema opaco
Colonoscopía
Es muy importante recalcar que la mayoría de los pacientes con diverticulosis no complicada son diagnosticados por hallazgo mientras se realiza algún estudio de imagen, indicado por síntomas abdominales no relacionados con la enfermedad diverticular.
Tratamiento
Es fundamentalmente dietético. Se les recomienda a los pacientes seguir una dieta rica en frutas y verduras con el fin de mantener una ingesta diaria de, por lo menos 32g de fibra.
El tratamiento farmacológico no es la primera elección pero se pueden indicar antiespasmódicos o anticolinérgicos si existen molestias similares a el síndrome de colon irritable
Diverticulosis complicada
Diverticulitis
Es la complicación más común de la enfermedad diverticular (10-25% de todos los casos). Se trata de la abrasión de la mucosa de los diverticulosis secundario a un proceso inflamatorio, generalmente originado a causa de la presencia fecalitos:
 Suele ser clínico por los síntomas mencionados anteriormente. En la exploración física vamos a encontrar dolor a la palpación superficial y profunda, signos de irritación peritoneal y presencia de masa. No es poco común encontrar leucocitosis en los laboratorios. Cuando existe duda sobre el diagnóstico, se puede recurrir a métodos de imagen, siendo la tomografía el de mayor utilidad. La colonoscopia está contraindicada debido al alto riesgo de perforación.
Suele ser clínico por los síntomas mencionados anteriormente. En la exploración física vamos a encontrar dolor a la palpación superficial y profunda, signos de irritación peritoneal y presencia de masa. No es poco común encontrar leucocitosis en los laboratorios. Cuando existe duda sobre el diagnóstico, se puede recurrir a métodos de imagen, siendo la tomografía el de mayor utilidad. La colonoscopia está contraindicada debido al alto riesgo de perforación.
Bibliografía
Divertículos en el colon con decalitros en su interior
Clínica
El síntoma más común es el dolor, que varia su localización según la altura del tracto digestivo en el cuál se encuentre el foco inflamatorio, siendo la fosa iliaca derecha la zona de mayor incidencia. Cabe recalcar que éste síntoma puede estar ausente en pacientes inmunodeprimidos. Otros síntomas que se pueden encontrar son:
- Fiebre
- Estreñimiento
- Nauseas
La mayoría de los pacientes tiende a buscar atención médica después de 48-76 horas de haber comenzado el cuadro. Este retraso puede predisponer a otras complicaciones como son: obseso por ruptura de los divertículos, que en algunos casos puede llegar incluso a una peritonitis, oclusión intestinal y estenosis
Diagnóstico
 Suele ser clínico por los síntomas mencionados anteriormente. En la exploración física vamos a encontrar dolor a la palpación superficial y profunda, signos de irritación peritoneal y presencia de masa. No es poco común encontrar leucocitosis en los laboratorios. Cuando existe duda sobre el diagnóstico, se puede recurrir a métodos de imagen, siendo la tomografía el de mayor utilidad. La colonoscopia está contraindicada debido al alto riesgo de perforación.
Suele ser clínico por los síntomas mencionados anteriormente. En la exploración física vamos a encontrar dolor a la palpación superficial y profunda, signos de irritación peritoneal y presencia de masa. No es poco común encontrar leucocitosis en los laboratorios. Cuando existe duda sobre el diagnóstico, se puede recurrir a métodos de imagen, siendo la tomografía el de mayor utilidad. La colonoscopia está contraindicada debido al alto riesgo de perforación.
Complicaciones
- Abseso: Es una de las complicaciones más comunes. El tratamiento suele ser a base de antibióticos. En caso de no haber respuesta o si el absceso tiene un tamaño mayor a 5cm, se debe recurrir al drenaje percutáneo. Solo aquellos que sean multiloculados o de recurrencia después del drenaje percutáneo, son indicación de cirugía.
- Fístula: La fístula colovesical es la más frecuente. El síntoma más común es la neumaturia y fecaluria. En mujeres es muy poco frecuente ya que el útero brinda cierto grado de protección. El tratamiento es quirúrgico.
- Obstrucción: Suele tener etiología muy variadas; desde la inflación por si misma, estenosis, o retráctil. El tratamiento quirúrgico está indicado cuando existe duda sobre la benignidad de la estenosis.
- Perforación libre: Es poco habitual y se presenta mayor mente en pacientes inmunodeprimidos. El tratamiento es una urgencia quirúrgica.
- Miguel Angel Montoro. (2012). Gastroenterología y hepatologia. Madrid, España: Jarpyo editores .
- Basso G, Chistolini F, Morelli A. Pathophysiological aspects of diver cular disease of colon and role of large bowel mo lity. World J Gas- troenterol 2003;9:2140-2.
Enfermedad de Addison
Introducción
La enfermedad de Addison se caracteriza por una oferta insuficiente de hormonas corticosuprarrenales para mantener las demandas periféricas y cursa como un síndrome constitucional con melanodermia e hipotensión. En la mayoría de los casos (80%) es secundario a un proceso de atrofia de la corteza suprerrenal de origen autoimmune. A principios de siglo, la causa principal de insuficiencia corticosuprarrenal era la tuberculosis extrapulmonar pero la reciente baja en la incidencia de la tuberculosis ha cedido el paso a la enfermedad autoimmune como principal etiología. Está última será el objetivo central del siguiente artículo.
Epidemiologia
Tiene una incidencia de 0.83 casos por cada 100,000, con una prevalencia de 4-6 por cada 100,000. La edad media de presentación es de 30-80 años. Es tres veces más frecuente en el sexo femenino.
Etiopatogenia.
Al igual que la mayoría de las enfermedades autoinmunes, la enfermedad de Addison requiere una compleja relación entre factores ambientales y genéticos para su desencadenamiento:
Elementos ambientales inductivos:
Las infecciones virales en individuos genéticamente predispuestos pueden desencadenar la autoinmunidad. Se han relacionado infecciones por Klebsiella pneumoniae y el desarrollo de la enfermedad de Addison. El mecanismo por el cuál se origina la autoinmunidad no se conoce con exactitud pero se sospecha de mimetismo molecular, y aumento de la presentación antigénica de autoantígenos durante la infección, secundario a un aumento en la secreción de IL-2.
Predisposición genética:
Se han descrito dos síndromes poliglandulares de naturaleza auto inmune (SPA I y SPA II), que presentan cierta susceptibilidad genética, entre los cuales se encuentra la enfermedad de Addison. Estos síndromes son debidos al desarrollo de linfocitos T o anticuerpos contra proteínas de las células glandulares y no glandulares. Existe un al menos un antecedente familiar de la enfermedad en un 30-50% de los pacientes. Estos trastornos en la inmunoregulación son dependientes varios genes HLA (cromosoma 6), más específicamente en los alelos DR3 y B8. El hecho de que solo un porcentaje de los pacientes con los genes predisponentes presente la enfermedad sugiere que puede haber otros genes relacionados o que los factores ambientales juegan un papel fundamental.
Autogénesis:
 Más del 50% de los pacientes presentan anticuerpos frente a la corteza suprarrenal, aunque los niveles séricos de los mismos son bajos (ligeramente mayor en el sexo femenino). Su presencia indica cierta predisposición a la enfermedad, ya que son evidencia de una alteración inmunológica. Los autoanticuerpos por si solos no representan daño para la corteza suprarrenal ya que el verdadero daño al tejido es de tipo celular, por un aumento de linfocitos TH2 y diminución de linfocitos superiores (TH3).
Más del 50% de los pacientes presentan anticuerpos frente a la corteza suprarrenal, aunque los niveles séricos de los mismos son bajos (ligeramente mayor en el sexo femenino). Su presencia indica cierta predisposición a la enfermedad, ya que son evidencia de una alteración inmunológica. Los autoanticuerpos por si solos no representan daño para la corteza suprarrenal ya que el verdadero daño al tejido es de tipo celular, por un aumento de linfocitos TH2 y diminución de linfocitos superiores (TH3).
Se sospecha que las infecciones virales causan lisis de las células, liberando ciertas moléculas al medio extracelular, como la 17 y 21 hidroxilasa. Estás enzimas son captadas por las células presentadoras de antígeno, las cuales desencadenan la respuesta inmune al activar a linfocitos T citotóxicos contra la corteza suprarrenal.
Otra posible causa de la autoinmunidad es la expresión aberrante de moléculas HLA de tipo II por parte de las células de la corteza soprarrenal, secundaria al ambiente pro inflamatorio. De está manera las células del mismo tejido cumplen la función de células presentadoras de antígeno.
Efectos histológicos y metabólicos
El daño tisular comienza a evidenciarse con una disminución homogénea y bilateral de la corteza suprarrenal (caso contrario a la adrenintis tuberculosa, en la cual el daño suele ser unilateral y heterogéneo.) hasta llegar a una delgada lamina de tejido fibroso. Existe infiltración linfocitaria capsular que respeta la médula suprarenal. La destrucción de la corteza causa una deficiencia de gluco y mineralocorticoides. Los niveles bajos de estas hormonas interfieren con la retroalimentación negativa a nivel hipotalámico, causando niveles elevados de CRH y ACTH.
Signos y síntomas
Se pueden clasificar según la deficiencia de cada hormona:
- Deficiencia de glococorticoides (cortisol): Cursa con disminución de la gloconeogénesis que provoca hipoglucemia, astenia, adinamia y fatigabilidad muscular. Perdida de peso, diaforesis, dolor abdominal y cefalea. Pueden existir trastornos psicológicos como fatiga mental, depresión, irritabilidad, insomnio, e inquietud.
- Deficiencia de mineralocorticoides: A medida que se va destruyendo la corteza suprarrenal, los niveles de renina y angiotensina II a nivel plasmatico aumentan con el fin de mantener niveles normales de aldosterona, hasta que el grado de destrucción es tal que concluye con hipoaldosteronismo. Por consiente se pierden cantidades grandes de agua y sodio, lo que condiciona hipovolemia con hipotensión arterial y taquicardia refleja. Se suele presentar síncope, vértigo y avidez por la sal.
- Deficiencia de andrógenos: Pérdida del vello axilar y pubiano. Oligomenorrea y disminución del la líbido en ambos sexos.
El aumento de ACTH también causa con aumento de su precursor, la propiomielocortina. El aumento de la POMC causa un incremento del factor estimulante de melanocitos y una hiperpigmentación de la piel característica de la enfermedad de Addison. Dicha pigmentación suele encontrarse dentro o alrededor de la boca y en las manos.
Los síntomas pueden presentarse o exacerbarse de forma repentina bajo condiciones de estrés, ya que estoy aumenta las demandas de glococorticoides, en lo que se conoce como crisis Addisonianas.
Diagnóstico
Clínico: Por los signos y síntomas mencionados anteriormente y los antecedes heredo familiares.
Laboratorio:
- Biometría hemática: Anemia normocítica y normocrómica.
- Química sanguínea: Hipoglucemia e hiponatremia. En un 10-20% de los pacientes se ha encontrando hipercalcemia.
- Estudios hormonales: Elevación de la ACTH (Mayor a 50pg/l). En etapas iniciales los niveles de corticoesteroides pueden ser normales y en estadios avanzados llegar a ser imperceptibles (menores a 5mg/dl)
- Test de estimulación con ACTH. Puede ser rápida o prolongada, siento este último el de verdadero valor diagnóstico en la enfermedad de Addison. Consiste en la administración exógena de ACTH por tres días. Si después de dicho periodo los niveles de corticoesteroides se mantienen bajos, se trata de la enfermedad de Addison. Si hay respuesta a la ACTH exógena, se debe orientar el diagnóstico a ineficiencia hipofisiaria. La interpretación de los resultados se muestra a continuación.
- Diagnóstico inmunológico: La determinación de anticuerpos contra la corteza suprarrenal indica riesgo a padecer la enfermedad pero no un diagnóstico certero. Recientemente se han ensayado técnicas para la detección de enzimas estereoidogénicas, como la 17 y 21 hidroxilaza, las cuales poseen una mayor sensibilidad y especificidad.
Tratamiento
Tratamento tradicional:
Consiste en la administración de los gluco y mineralocorticoides que no se sintetizan. El fármaco de elección suele ser hidrocortisona o cortisona, ya que presenta un efecto dual (actúan como gloco y como mineralocorticoides). Las dosis de mantenimiento es de 20-25mg cada 24 horas de hidrocortisona o 25-35mg cada 24 horas de cortisona.
Nuevos tratamientos:
Implante subcutáneo de de desoxicorticoesterona. Se implantan directamente 500mg y la dosis se repite cada 6 a 12 meses, según el estado del paciente. Normalmente se colocan haciendo una pequeña inacción en el abdomen.
Bibliografía:
- Arthur C. Guyton . (2011). Tratado de fisiología humana. Madrid, España: Elsevier .
- F. J. CANDEL GONZÁLEZ, M. MATESANZ DAVID, I. CANDEL MONSERRATE. (2001). Insuficiencia corticosuprarrenal primaria. Enfermedad de Addison. AN. MED. INTERNA, 18, 492-498.
domingo, 26 de febrero de 2017
Histoligía de sistema endócrino
Hipófisis
Recibe estímulos del hipotálamo, el cual tiene más de 90 centros. Desde el punto de vista endocrino, el hipotálamo tiene dos centros importantes, ambos secretan vasopresina y oxitocina aunque cada uno tiene predominancia por alguna de las dos hormonas, estos centros son:
- Supraóptico: Secreta más vasopresina (antidihurética)
- Paraventricular: Secreta más oxitocina (hormona del apego)
La hipófisis tiene dos porciones, una neurohpófisis (lóbulo posterior) y una adenohipófisis (lóbulo anterior)
Neurohipófisis:
Componentes histológicos
- Neuronas (axones). Los cuerpos de las mismas se encuentran en el hipotálamo.
- Cuerpos de Henry (almacen de neurotransmisonres como Acetil colina)
- Pituicitos (astrocitos modificados). Son células de la neuroglia que cumplen función de barrera
- Vasos sanguíneos fenestrados
No es una glándula, es una zona de almacenamiento. Tiene pocas células como se muestra a continuación:
Macroscópicamente, podemos dividir a la hipófisis en distintas porciones, las cuales son:
Porciones de la Neurohipófisis: De cefálico a caudal
- Eminencia media: Inició del tracto hipotálamo hipofisiario, se pueden encontrar todavía algunos cuerpos celulares.
- Infundibulo.: Tracto como tal, solo axones
- Pars nerviosa: lóbulo posterior de la hipófisis

La neurohíipófisis responde a estímulos del medio ambiente para la liberación de hormonas. Procesados por la corteza cerebral.
Adenohipófisis
Porciones:
- Distal (más grande): Las células se organizan en cordones.
- Medial (entre la neuro y la adenohipófisis)
- Porción tuberal (envuelve al tallo o infundíbulo H-H)
Los cuerpos carotídeos (en la bifurcación de las carótidas) y aórticos detectan baja en la presión arterial. Esta señal estimula a los núcleos paraventricular y supraóptico para la liberación de vasopresina, para retener agua y aumentar la TA. En grandes cantidades, la ADH causa vasocontrición, puede causar daño renal si se mantiene por mucho tiempo.
Componentes celulares de la adenohipófisis.
Pars distal
Cromófobas: La mayor cantidad de células constituyentes del a adenohipófisis (50%), en sus tres porciones, son croomófobas. No tienen función clara, se supone que son células que ya han descargado su contenido y por eso no tienen qué teñir. Pueden ser células de transición o células no funcionales.
Basófilas: corresponden a el 10% de todas las células. Se dividen en:
- Corticotropas (15%) Medianas y redondas. Secreta pro opiomelatocortina, hormona inactiva que se fragmenta para general adrenocorticotrópica, encefalinas, endorfinas.
- Tirotropas (5%). Son las más grandes. Secretan hormona estimulante de tiroides o tirotropina, estimula la tiroides para sacar del coloide T3 y T4. Se inhibe por la somatostatina.
- Gonadodropas (10%) Pequeñas y redondas. Produce hormona folículo estimulante (FSH) en las mujeres y en los hombres hormona estimulante de células intersticiales. Ambos para la maduración de gametos. El estímulo inhibitorio es: Hormona inhibitoria de gonadotropinas y melanina.
- Somatotrompas, de tamaño medial, producen la hormona del crecimiento. (es una proteína), aumenta la cantidad de tejidos como el óseo, adiposo, etc. El estímulo proviene de un factor liberador del hipotálamo, que secreta hormona liberadora de hormona del crecimiento. Esta hormona estimulante llega a la adenohipófisis a través del sistema porta hipofisiario. Formado por la arteria hipofisiaría superior e inferior. La A.H superior termina en capilares, recoge el contenido del hipotálamo y forma la vena porta hipofisiaria. Desciende por el infundíbulo y se ramifica en la adenohipófisis. Al ser proteína, debe tener receptor específico en la membrana. El sistema termina en las venas hipofisiarias superior e inferior. El efecto de la hormona más la contracción en sangre, se encargan de estimular al hipotálamo para la secreción de somatostatina, para bloquear el efecto de la GH (factor inhibidor)
- Mamotropas: (15%)Producen prolactina, de naturaleza proteica, misma vía que la anterior. El estímulo es por el embarazo libera hormona liberadora de prolactina. Tienen grandes gránulos. La dopania tiene efecto de inhibición en la prolactina.
En la adenohipófisis existen capilares sinusoides.
Pars intermedia
- Posee cordones de células básofilas y cromófobas.
- Existen quistes colides (quistes de Rathke)
- Parecen secretar hormona estimulante de melanocitos (MSH alfa), en los basófilos.
Pars tuberal
- Muy vascularizada (ramas de la vena porta)
- Cordones longitudinales de células cúbicas y aplanadas
- Basófilas
- No se sabe si produce hormonas
Glándula pineal
- Se encuentra en el techo del diencéfalo, unida por un pedículo.
- Tiene forma de almendra
- Produce melatonina

Componentes histológicos
- Cápsula de tejido conjuntivo (extención de la piamadre) que la divine en lóbulos incompletos, dentro de estos se encuentran los elementos celulares que son:
- Pinealocitos. Células principales de la galándula pineal, tienen forma de pulsos y se reconocen por el gran tamaño de sus núcleos. Tienen prolongaciones de citoplasma a través de las cuales se transportan las vesículas .
- Células de la neuroglia: Astrocitos. Se encuentran entre cada prolongación de los pinealocitos, separan a estos de los vasos sanguíneos. Las sustancias tienen que pasar a través de ellos.
- Arenilla cerebral o acérvulos: No son celulas, se trata de un componente mineral formado por cristales de hidroxiapatita de calcio. Se encuentran entre los espacios intercelulares, denominadas arenilla cerebral.
Controla el ciclo sueño vigilia y es debido a la calcificación de la arenilla cerebral causa alteraciones de estos ciclos en edades avanzadas.
Melatonina
- Vía de estimulación: La luz estimula la retina, que manda las señales al núcleo supraquiasmático del hipotálamo, después al Has multisinaptico, tronco simpático, ganglio cervical superior, núcleo coronario de la epífisis, producción de melatonina. En el día se inhibe, en la noche se estimula.
- Inhibe la gonadotropona inhibiendo la liberación de hormona liberadora de gonadotropinas
- Tiene función antioxidante.
- Regula la concentración de glucosa en sangre (falta de sueño aumenta la glucosa por disminución de melatonina)
- Inmunoregulación
Tiroides
 Glándula única, delimitada por una cápsula de tejido conjuntivo (colágeno fino) que al invaginarse crea los lóbulos y lobulillos tiroideos. Cada lobullilo está lleno de varios folículos tiroideos, que son la unidad básica de la glándula. Donde no existen lobullios, hay tejido conjuntivo laxo (el estroma)
Glándula única, delimitada por una cápsula de tejido conjuntivo (colágeno fino) que al invaginarse crea los lóbulos y lobulillos tiroideos. Cada lobullilo está lleno de varios folículos tiroideos, que son la unidad básica de la glándula. Donde no existen lobullios, hay tejido conjuntivo laxo (el estroma)
Componentes histológicos.
- Formado por un conjunto de células cúbicas simples dispuestas en forma circular, constituyendo la pared. Reciben el nombre de células foliculares. Estas producen T3 y T4, cuyo efecto es aumentar el metabolismo basal, promoviendo la utilización de lípidos, carbohidratos.
- En el centro del lobulillo se encuentra una sustancia gelatinosa llamada coloide.
- Entre cada lobulillo existen células de sostén: las células para foliculares o células C. Secretan calcitonina. Regula las concentraciones de calcio. Tiene un efecto hipocalcemiante, disminuyendo la absorción de calcio a nivel intestinal y renal y promoviendo su fijación a los huesos.
- El resto de la glándula está compuesto por tejido conjunto, vasos sanguíneos fenestrados, fibras, etc
Células foliculares
- Son derivados de aminoácidos.
- Inicia su mecanismo de secreción al recibir estímulo de la hormona estimulante de tiroides o tirotropina (producida en la adenohipófisis que a su vez es estimulada por el hipotálamo, que secreta hormona liberadora de tirotropina)
- Al ser de naturaleza protéica, necesita un acarreador específico, producida por la misma célula
- La TCH estimula a la célula folicular para producir tiroglobulina (en el retículo endoplásmico rugoso)
- La célula folicular también toma yodo de la sangre, lo transporta al coloide donde se adhiere a la tiroglobulina, en sus abundantes residuos de tirosina, se puede unir uno o dos yodos a los residuos (moni y diyodados), por acción encimática estos residuos se dividen
- La célula folicular los regresa de la luz al vaso sanguíneo en vesículas, mientras los conjuga, si une un residuo di yodado con un monoyodado, se genera T3, si son dos diyodados, se genera T4, del vaso se van a sus órganos blanco.
- Se produce más T4 que T3, pero T3 tiene efecto más potentes.
Paratiroides
Son 4,Ubicadas en la parte posterior de la tiroides. Tienen forma de lenteja.
Componentes histológicos
- Cápsula de tejido conjuntivo delgado
Parénquima formado
- Células principales: Encargadas de formar la hormona de la glándula: paratohormona u hormona paratiroidea. La función de está hormona es lo contrario a la calcitonia; aumenta la cantidad de calcio, Tinción ligeramente acidófila.
- Células oxífilas o acidófilas: Son las que captan mayor cantidad de colorante. Son más grandes y menos numerosas, se desconoce su función. Se tiñen más
- Tejido conjuntivo delgado que sustenta vasos sanguíneos fenetrados.
- A partir de la pubertad, el tejido adiposo aumenta gradualmente.
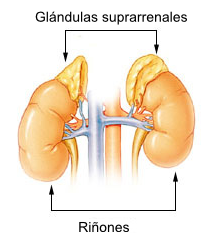
Glándulas Suprearenales
Corteza: Zona glomerular, fascilulada y reticular
Médula: Células cromafines.
Estructura histológica
Corteza
- La zona glomerular es la más superficial y tiene células dispuestas en glomérulos (bolita de células)
- En la zona fasiculada las células están dispuestas en fasículos (tiras). Es la zona más amplia (80%) y la que menos se tiñe. Sintetizan glococorticoides (cortisol) controlan el metabolismo de carbohidratos, proteínas y grasas. Es estimulada por la ACTH
- La zona reticular está compuesta por los mismos fascículos pero entrecruzados (dando la apariencia de formar una red). Producen dehidroepiandrosterona (DHEA). Hormona masculinzante.
- La corteza forma anillos concéntricos, compone en 13% del volumen total
- Produce mineralocorticoides, principalmente aldosterona, que aumenta la absorción de sodio y agua, aumentando el volumen sanguíneo. Controla el equilibrio de líquidos e iones. de
- Se estimula por la angiotensina II y la ACTH
Médula
Representa el 10% de toda la glándula
Formada por cordones celulares
Está sumamente vascularizada.
- Células ganglionares: Son terminaciones nerviosas provenientes de ganglios simpáticos, estimulan a las células cromafines para producir catecolaminas: Estado de alerta
- Células cromafines: Liberan catecolaminas a los vasos.
Suscribirse a:
Entradas (Atom)
Entrada destacada
Fiebre reumática
La fiebre reumática es una enfermedad inflamatoria sistémica no supurativa originada como secuela tardía de una faringitis por Estreptococ...

-
Límites Intrínsecos: Superior: Decruzamiento de las pirámides Inferior: Cono medular Extrínse...
-
Nemotecnia: Alicia Por definición: La mnemotecnia o nemotecnia es el proceso intelectual que consiste en establecer una asociación o ...
-
Definición El neumotorax se define como la entrada de aire a la cavidad plural. Lo cual causa en mayor o menor medida colapso pulmonar, ...